Termokimia
Cabang kimia yang mempelajari tentang kalor (panas)
Besarnya energy yang dimiliki suatu zat
dinamakan entalpi.
Entalpi
dinotasikan dengan H (heat content)
Besar entalpi tidak dapat dihitung namun yang
dapat diukur hanyalah perubahannya.
Perubahan ditandai ΔH
Perubahan entalpi yakni pembebasan / penyerapan
kalor pada zat atau besarnya kalor yang diterima / dilepas dari suatu reaksi
kimia.
Reaksi
Eksoterm dan Endoterm
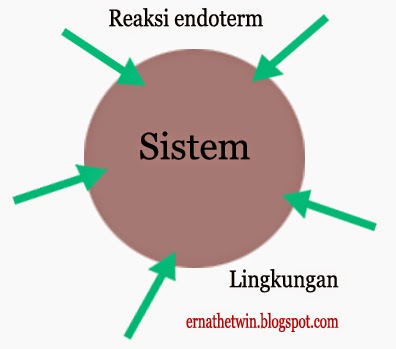
Sistem merupakan pusat perhatian / daerah jadi
pusat perhatian.
Lingkungan yakni daerah yang membatasi sistem.
Reaksi endoterm
Reaksi
yang menyerap panas
ΔH
= +
Contoh
: spritus.
Reaksi Eksoterm
Reaksi
yang melepas panas
ΔH
= -
Contoh:
Air kapur
Jenis – jenis Perubahan Entalpi
1.
Perubahan
entalpi standard (ΔH0)
Perubahan kalor yang dibebaskan / dibutuhkan pada reaksi kimia pada suhu
+ tekanan standard pada 250C dan 1 atm.
1 kalori = 4, 184 Joule
Satuan energy = Joule
00C = 2730 Kelvin
2.
Perubahan
entalpi pembentukan standard (ΔH0f)
Besarnya kalor yang dibutuhkan / yang dibebaskan 1 mol senyawa dari unsur
– unsurnya pada keadaan standard.
Contoh:
ΔH0f H2O = -242 Kj/mol
Pembentukan 1 mol dari unsur H2O melepaskan kalor sebesar
242.
Persamaan terokimia:
H2 + ½O2 → H2O
ΔH0f = -242 Kj
ΔH0f KClO3
= -391,2 kg/mol
Persamaan terokimia:
K + ½Cl2 + 3/2O2 → KClO3
ΔH0f -391,2 Kj
3.
Perubahan
entalpi penguraian standard
Besarnya kalor yang dibutuhkan / diperlukan untuk menguraikan 1 mol
senyawa – senyawa menjadi unsure – unsurnya pada keadaan standard.
Contoh:
ΔH Penguraian CO2 = 395,5 Kj
Persamaan terokimia
CO2 → C + O2
ΔH = 395,5 Kj
ΔH Penguraian H2SO4 = 863
Kj/mol
Persamaan terokimia
H2SO4 → H2 + S + 2O2
ΔH = 863 Kj
4.
Perubahan
entalpi pembakaran standard
Besarnya kalor yang dilepaskan untuk membakar 1 mol zat pada keadaan standard.
(hanya terjadi pada reaksi eksoterm).
Pembakarannya memerlukan O.
Contoh:
ΔH pembakaran C(s) = - 393,5 Kj/mol
Persamaan terokimia:
C + O2 → CO2
ΔH = - 393,5 Kj



0 comments:
Post a Comment